17. Mai 2022 von Juan Carlos Peñafiel Suárez und Dr. Vanessa Stahl
Warum eine Computersystemvalidierung wichtig ist und welche Vorteile sie mit sich bringt
Der Weg zur erfolgreichen Digitalisierung im Labor erfordert den Einsatz von IT-Systemen.
Während bei manuellen Prozessschritten ein Großteil der Dokumentation und des Datenaufkommens auf Papier festgehalten wird, bringt ein erhöhter Digitalisierungsgrad ebenso ein erhöhtes Datenaufkommen mit sich. Damit wird es umso wichtiger sicherzustellen, dass die eingesetzten IT-Systeme validiert sind, damit die generierten und verarbeiteten Daten den geforderten Qualitätskriterien unterliegen.
In diesem Blog-Beitrag möchten wir erläutern, warum Computersystemvalidierung (CSV) im Labor von so hoher Wichtigkeit ist und welche schwerwiegenden Probleme sowohl inhaltlicher als auch wirtschaftlicher Art es zu vermeiden gilt.
Die Wichtigkeit von CSV
Führt man sich die Definition des Begriffs Computersystemvalidierung vor Augen, so wird die Wichtigkeit ihrer Durchführung verdeutlicht. Es handelt sich um einen dokumentierten Prozess, mit dem konsistent und reproduzierbar sichergestellt wird, dass ein Computersystem genau das tut, wofür es entwickelt wurde. Dies meint die Prüfung sowohl der System- als auch der Stakeholder-Anforderungen bzw. der Zweckbestimmung. Während die Systemanforderungen beschreiben, was das computergestützte System können muss, definiert Letzteres die Anforderungen der Nutzer an das System selbst. Würde nur die Erfüllung der Systemanforderungen geprüft werden, entspräche dies einer Verifizierung. Demnach ist für die Durchführung einer erfolgreichen Computersystemvalidierung die Prüfung beider Anforderungstypen unumgänglich.
Besonders im pharmazeutischen Bereich werden hohe Anforderungen an computergestützte Systeme gestellt. Die Herausforderungen liegen hierbei in der wachsenden Komplexität der Datensysteme, die im Labor ihren Einsatz finden, sowie dem stärker werdenden Fokus auf Datenintegrität.
Ein computergestütztes System findet seinen Einsatz nach Freigabe der durchgeführten Computersystemvalidierung. Voraussetzung hierfür ist die Einhaltung der im pharmazeutischen Bereich vorgegebenen Regularien, die durch die Behörden geprüft wird. Einen detaillierten Einblick, welche Fehler es zu vermeiden gilt, ermöglichen die Warning Letters der Food And Drug Administration (FDA).
Quelle von Fehlern
Die FDA führt ständig Audits bei allen Unternehmen durch, die unter den Regularien der FDA arbeiten sollen. Die FDA geht sehr öffentlich mit den Ergebnissen dieser Audits um, denn sie werden öffentlich zugänglich gemacht. Jede Person mit Zugang zum Internet kann sich die Warning Letters anschauen.
Dort kann man wertvolle Informationen darüber gewinnen, welche Fehler die Unternehmen in einem Bereich, unter anderem CSV, gemacht haben. Die Warning Letters beinhalten nicht nur Informationen über das, was die Unternehmen nicht beachtet hatten, sondern auch über die Korrekturmaßnahmen, die das Unternehmen relativ kurzfristig hätte umsetzen sollen, damit die entdeckten Fehler nicht „angezeigt“ werden. Sind die Korrekturmaßnahmen nicht gut genug für die FDA, wird ein Bericht geschrieben und letztendlich dieser als Warning Letter öffentlich publiziert. Die Veröffentlichung der Informationen wirkt auf jeden Fall so, dass das Unternehmen viel mehr Druck hat, die Fehler zu korrigieren. Dies ist eine Situation, die jedes Unternehmen vermeiden will. Denn nicht nur werden die Fehler des Unternehmens der Konkurrenz bekannt, sondern auch der Ruf des Unternehmens wird oft geschädigt, was wirtschaftliche Folgen nach sich zieht. Darüber hinaus kann das Unternehmen diejenigen Produkte, die von den Fehlern betroffen sind, nicht weiter herstellen, so dass der Schaden noch größer wird.
Die häufigsten Fehler
Eine Analyse aus mehreren Warning Letters der FDA zeigt, dass es einige Fehler im Bereich Computersystemvalidierung gibt, die sich oft wiederholen. Diese sind:
- Keine Backups vorhanden
- Keine Zugangsbeschränkungen bei Computersystemen
- Fehlende Benutzung der Fähigkeiten einer Software, Daten zu speichern
- Keine vollständigen Unterlagen oder Aufzeichnungen
- Ungeschützte Daten, die von jedem gelöscht oder verändert werden können
- Keine Benutzerkonten vorhanden
- Benutzung von nicht validierten Tabellenkalkulationen
Sich Hilfe zu holen ist empfehlenswert und oft notwendig
Die Situation eines Unternehmens mit einem Warning Letter ist alles andere als schön. Denn der öffentliche Druck und der laufende wirtschaftliche Schaden helfen nicht wirklich dabei, die Fehler zu korrigieren, vor allem wenn es um eine Computersystemvalidierung geht. In der Regel wird eine Analyse des Systems benötigt, um die besten Lösungen zu finden. Als Nächstes erfordert die Implementierung solcher Lösungen Zeit und Geld. Um dies schnell und effektiv durchzuführen, wird den Unternehmen oft empfohlen, sich Hilfe von Fachleuten zu holen, die Erfahrung in diesem Bereich mitbringen und die Situation aus einem neuen Blickwinkel betrachten. Dies ist oft die beste Lösung, da für diese Arbeit oft zusätzliche Ressourcen benötigt werden, die nach der Endphase freigesetzt werden können. Eine Gruppe von externen Fachleuten steht dem Unternehmen zur Seite, solange sie benötigt werden.
Regulatorische Anforderungen für eine CSV
Es gibt keine genau definierten regulatorischen Anforderungen für eine CSV, sondern nur sehr allgemein formulierte Anforderungen. Das macht insofern Sinn, als die Technologie sich ständig weiterentwickelt, so dass genau definierte regulatorische Anforderungen ständig aktualisiert werden müssten. Darüber hinaus sind die Prozesse und Computersysteme, die zu validieren sind, so komplex, dass es kaum möglich ist, Standardlösungen zu finden bzw. vorzuschreiben.
Wichtige Dokumente, die für eine CSV beachtet werden sollten, sind:
- FDA 21 CFR (Code of Federal Regulations) Part 210
- FDA 21 CFR Part 211
- FDA 21 CFR Part 11
- EU GMP Annex 11
- GAMP5 (Good Automated Manufacturing Practices)
Da die Lösungen nicht vorgeschrieben werden, haben Unternehmen die Möglichkeit, selbst die passenden Lösungen für ihre CSV zu finden. Dies ermöglicht einen großen Spielraum, wo Kreativität, Wissen, Technologie und Dokumentation zusammengebracht werden müssen, um die optimalen Lösungen zu finden.
Tipps für eine CSV / Wie man die häufigsten Fehler vermeiden kann
Ein gut ausgedachter Plan
Eine CSV muss im Voraus geplant werden. Es gibt verschiedene Modelle dafür. Eins der bewährten Modelle ist das V-Modell. Dabei wird zuerst eine Stufe abgeschlossen, bevor die nächste anfängt. Diese hängt sehr stark vom Inhalt der letzten ab. Wichtig bei dem V-Modell ist, dass fast die Hälfte aller Stufen (rechte Seite des V-Modells) die erste Hälfte (linke Seite des V-Modells) verifiziert. Damit hat man eine systematische Arbeitsweise. Der Erfolg einer Stufe hängt immer von der Qualität und dem Erfolg der vorherigen Stufen ab. Aus diesem Grund lohnt sich Zeit, um Wissen in jeder Stufe zu investieren, um die Qualität der Ergebnisse jeder Stufe zu erhöhen.
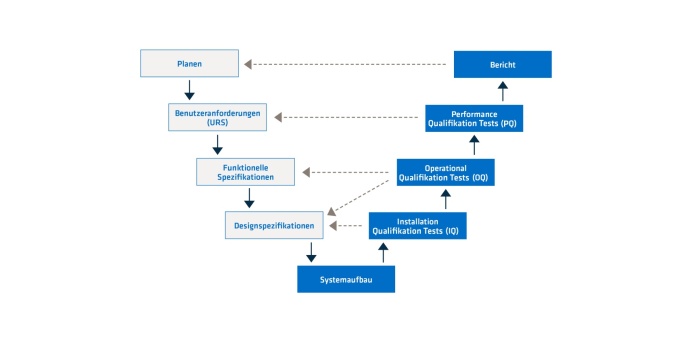
Klare und präzise Benutzeranforderungen
Nur wer die Anforderungen der eigenen Computersysteme und der eigenen Prozesse kennt, kann diese gut beschreiben und weiß, was getestet werden soll, damit diese Anforderungen erfüllt werden. Damit wird auch der Umfang der CSV definiert. Die Validierung verbraucht viele Ressourcen, und diese sollten nicht unnötig eingesetzt werden, das heißt, die Ressourcen sollen nicht in Aufgaben involviert werden, die später nicht relevant für die Anforderungen sind. Klare und präzise Anforderungen helfen dabei, dies zu vermeiden.
Ständige Kommunikation mit der Qualitätssicherung
Computersysteme sind oft komplex. Daten werden erzeugt, die eventuell noch ausgewertet werden müssen. Die Prozesse, die durch die Computersysteme unterstützt werden, sollen noch überwacht werden. Die Dokumentation dieser Prozesse muss klar und genau sein. Diese Aufgaben sind sehr aufwendig, so dass sich das Personal sehr selten allein mit einer CSV beschäftigen kann. Aus diesen Gründen existiert die Qualitätssicherung, die in ständigem Austausch mit den Prozessverantwortlichen steht und dabei ständig die Gültigkeit der CSV prüft und bei einer Validierung bzw. Re-Validierung unterstützt. Die beidseitige Kommunikation ist sehr wichtig, so dass die Qualitätssicherung gut über die Prozesse Bescheid weiß und die Prozessverantwortlichen gut über die aktuellen Anforderungen an eine CSV informiert sind.
Risikobasiertes Denken
Wenn im Dokument GAMP5 über einen risikobasierten Ansatz gesprochen wird, betont, dass diese Vorgehensweise wichtig ist. Die Identifizierung von Risiken ist wichtig, denn damit können Maßnahmen getroffen werden, um die Eintrittswahrscheinlichkeit dieser Risiken zu minimieren. Zusätzlich können nicht nur Chancen verstärkt werden, sondern auch Verbesserungen erreicht werden. Aus diesen Gründen ist eine Risikobewertung entscheidend für den Erfolg einer Computersystemvalidierung. Es empfiehlt sich, nicht nur Dokumentation oder Methoden zu führen, um Risiken zu identifizieren und zu bewerten, sondern auch, dass das Personal eines Unternehmens dieses risikobasierte Denken entwickelt. Damit kann jeder dazu beitragen, Risiken in der Zukunft zu identifizieren.
Fazit
Heutzutage wird eine Computersystemvalidierung von den regulatorischen Behörden bei Produktionsprozessen von Arzneimitteln oder Medizinprodukten verlangt. Mit der Validierung können die Unternehmen schriftlich nachweisen, dass ihre Computersysteme so arbeiten, wie von ihnen erwartet wird. Dies ist nicht nur für eine Zulassung relevant, sondern auch für die Effektivität des Prozesses. Eine CSV hilft dabei, Prozesse gut zu definieren, Risiken zu minimieren und Chancen zu erhöhen. Damit ist der hohe Aufwand von Ressourcen für eine Validierung eine Investition, die sich zukünftig immer lohnt.
Weitere spannende Blog-Beiträge aus der adesso-Welt findet ihr in unseren bisher erschienenen Blog-Beiträgen.




