27. November 2025 von Aleksandar Đorđević und Dr. Ferenc Liedl
55 Prozent weniger Validierungsaufwand – Ein Traum?
Seit der Veröffentlichung des Entwurfsleitfadens zur Computer Software Assurance (CSA) durch die Food and Drug Administration (FDA) 2022 hat das Thema lebhafte Diskussionen angestoßen. Die Meinungen zur Leitlinie gehen dabei weit auseinander.
Kritikerinnen und Kritiker bemängeln, dass CSA keinen echten Mehrwert biete, da der etablierte Ansatz der Computer System Validation (CSV) bereits alle wesentlichen Aspekte abdecke. Zudem wird die fehlende Klarheit der Leitlinie kritisiert, die bei der Umsetzung zu Unsicherheiten und Verwirrung führen könnte.
Auf der anderen Seite erkennen Befürworterinnen und Befürworter deutliche Vorteile in der Einführung der CSA-Methodik, insbesondere mit Fokus auf risikobasiertes Testen. In der Praxis haben Unternehmen aus der Medizintechnik und Pharma-Branche bereits begonnen, die Methodik zu integrieren. Dadurch konnten erste Erfahrungen gesammelt und die Praktikabilität sowie Effektivität der CSA-Methodik getestet werden.
Dieser Blog-Beitrag erläutert die zentralen Prinzipien und beleuchtet den Mehrwert der CSA-Methodik. Wir geben euch einen Einblick in konkrete Effizienzen und Hindernisse, welche wir in einem Kundenprojekt beobachten konnten.
Aktueller Hype: Computer Software Assurance (CSA)
Die Veröffentlichung der Leitlinie zur Computer Software Assurance hat seit der Veröffentlichung Ende September Wellen im IT-Quality-Bereich der Life-Sciences-Branche geschlagen. Vor allem auf LinkedIn wurde viel zu CSA und der Relevanz anhand der aktuellen Veröffentlichung der Leitlinie gepostet. Wir wollen euch einen kurzen Überblick über die Methodik geben, die Nützlichkeit an einem realen Use Case erläutern und einen konkreten Weg zur Nutzung der CSA aufzeigen.
Was steck hinter der CSA-Methodik?
Die CSA-Methodik wurde von der US Food and Drug Administration (FDA) als Reaktion auf technologischen Fortschritt und steigenden regulatorischen Druck entwickelt. Die Methodik wurde 2022 als Draft und am 24. September 2025 final veröffentlich. Die CSA-Leitlinie der FDA fokussiert sich streng genommen auf die Anwendung im Medizintechnik-Umfeld, kann aber auch im pharmazeutischen Umfeld angewendet werden. Die von der FDA vorgestellte Methodik zur CSA kann als Teilmenge der Computersystemvalidierung nach der GAMP®5-Leitlinie betrachtet werden. Den Grundpfeiler der Methodik bildet der risikobasierte Ansatz. Die konsequente Anwendung des risikobasierten Ansatzes dient der Fokussierung auf kritische Softwarefunktionen, der Reduktion unnötiger Validierungsaufwände und der generellen Effizienzsteigerung im Validierungsprozess.
Vereinfacht kann die CSA-Methodik in folgende Grundprinzipien zusammengefasst werden:
- Bestimmung des beabsichtigten Systemzwecks: Grundlegende Einstufung, ob ein System direkt, indirekt oder nicht Teil des Produktions- oder QS-Systems ist.
- Risikobewertung bezüglich Funktions- und Prozessanforderungen: Bewertung mögliche Konsequenzen für die Produktsicherheit.
- Ableitung angemessener Qualitätssicherungsmaßnahmen: Berücksichtigung des beabsichtigten Zwecks und der Risikobewertung zur Ableitung einer Teststrategie, die risikoabhängig die Test- und Dokumentationstiefe gegen die jeweiligen Anforderungen vorgibt.
Welchen Mehrwert bietet die CSA-Methodik?
Viele regulierte Unternehmen haben moderne Validierungsansätze aufgrund der Komplexität, langwierig eingespielter Prozesse oder mangelnder Ressourcen bisher nicht eingeführt. Dabei kann die Anpassung des aktuellen CSV-Frameworks gängigen Pain Points wie Prozesskomplexität und Ressourcenknappheit entgegenwirken. Gerade die zeitlichen Einsparungen im Bereich der Validierung produktionsnaher Systeme kann die Produktionsbereitschaft und damit die Time-to-Market Zeit signifikant verbessern. Bei der Erstbelieferung oder der Etablierung auf dem US-Markt zeigt die Adaption der CSA-Methodik wiederum ein Verständnis der Idee des risikobasierten Ansatzes im Behördenaudit.
Life Sciences@adesso
Wir steigern eure Wertschöpfung
Bei adesso Life Sciences treffen Innovation und Regulierung aufeinander. Mit digitalen, GxP-konformen Lösungen begleiten wir Pharma-, Medtech- und Laborunternehmen bei ihrer Transformation – von der strategischen Beratung über KI-gestützte Datennutzung bis hin zur validierten Softwareentwicklung. Gemeinsam machen wir eure Prozesse effizienter, skalierbarer und zukunftssicher.
55 Prozent weniger Validierungsaufwand: Ein Kunden-Use-Case
Den konkreten Nutzen der Methode wollen wir kurz am Beispiel eines unserer Kundenprojekte zeigen. Ein Kunde aus dem globalen Medizintechnik-Umfeld hat uns mit der Optimierung seiner Validierungsprozesse beauftragt. Das Ziel war eine Prozess-Verschlankung von der Anforderungserhebung bis zum Abschluss des Testings. Dazu analysierten wir das aktuelle CSV-Framework und überarbeiteten die zentralen Vorgabedokumente.
Die Anpassung des CSV-Frameworks erfolgte eng mit dem Kunden zusammen und wurde direkt in einem Pilotprojekt auf seine Leistungsfähigkeit hin überprüft. Neben der schnellen Akzeptanz bei den zentralen Anwendungsteams konnte eine signifikante Reduzierung des Validierungsaufwands nachgewiesen werden. Nach der erfolgreichen Erstanwendung des neuen Frameworks wird die CSA-Methodik bei unserem Kunden mittlerweile unternehmensweit eingesetzt.
Vor und während der unternehmensweiten Anwendung wurden typische Validierungsaufwände kleiner (S), mittlerer (M) und großer (L) Validierungsprojekte überwacht. Zur Bewertung der Effizienzsteigerung wurden die Validierungsaufwände anschließend verglichen (siehe Tabelle 1). Die Validierungsaufwände bei Anwendung der CSA-Methodik mit unerfahrenen Teams wiesen bereits eine Aufwandsreduktion um circa 40 Prozent im Vergleich mit dem traditionellen CSV-Vorgehen auf. Nach einem Jahr intensiver Nutzung konnten Validierungsaufwände mit CSA-erfahrenen Teams sogar um bis zu 55 Prozent reduziert werden. Die Methodik wurde dabei unabhängig von der Implementierungskomplexität (kommerziell erworben, kundenspezifische Entwicklung, Open-Source) eingesetzt.
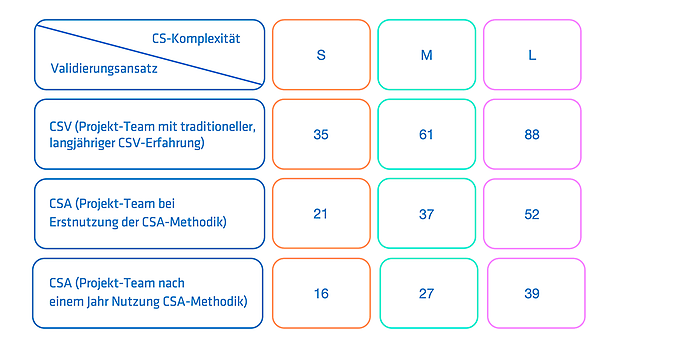
Gemessene Validierungsaufwände in Personentagen. Klassifizierung S/M/L gemäß unterschiedlichem Umfang an Use Cases und System-Schnittstellen.
Welche Stolpersteine können bei der Implementierung der CSA-Methodik auftreten?
Der Paradigmenwechsel hin zur risikobasierten Validierung muss durch die Schaffung eines entsprechenden Frameworks bedacht vorbereitet werden. Hierbei müssen bereichsübergreifende Teams aus Qualität, IT und Business eng kollaborieren, um Effizienzen tatsächlich heben zu können. Auch der Anwendungsbereich muss gut abgesteckt sein, um keine ungewollten Compliance-Probleme zu erzeugen. Insbesondere der damit einhergehende Mindset-Wandel von der aktuellen, dokumentenzentrierten Validierungspraxis hin zu einer risikobasierten Vorgehensweise muss kompetent begleitet werden.
Validierungsprozesse neu denken
Regulatorische Anforderungen und Prozessansätze zur CSV entwickeln sich weiter. CSA ist dabei ein maßgeblicher Hebel zu mehr Effizienz: Verbesserte Compliance bei weniger Aufwand. Prozesse zu modernisieren ist mehr als Prozessschemata umzustellen und neue Abläufe formal zu schulen. Gerade in IT-Großprojekten wie ERP-Einführungen haben wir gute Erfahrungen mit gezieltem organisatorischem Change Management gemacht. Unsere Fähigkeit, Prozessveränderungen kompetent zu planen, sie in kleinen Teams nah am Anwender zu erproben und anschließend ihre schrittweise unternehmensweite Einführung zu überwachen, macht uns zu einem starken Partner für die effiziente Nutzung moderner Methodiken wie CSA.
Wir unterstützen euch!
Lasst uns gerne über Möglichkeiten sprechen CSA bei euch im CSV-Umfeld zu integrieren. Zusammen schaffen wir den Spagat zwischen regulatorischen Anforderungen und operativer Effizienz!




